by
Claire Parent1, Nicolas Capelli1, Audrey Berger2, Michèle Crèvecoeur2, James F. Dat1*
1Laboratory of Chrono-Environment, UMR UFC/CNRS 6249 USC INRA, University of Franche-Comtè,
F-25030 Besanзon Cedex, France
2Plant Biology Department, University of Geneva, Quai Ernest-Ansermet 30, CH 1211 Geneva 4, Switzerland
Corresponding author * james.dat@univ-fcomte.fr
Disarikan oleh
Muhammad Hatta
ABSTRAK
Pada kondisi alami, tanaman sering tergenang air, baik sementara maupun permanen. Genangan air secara drastis mempengaruhi fisiko-kimia tanah, terutama potensial redoks, pH dan O2 tanah. Dengan demikian, kondisi hipoksia atau anoksia sering dialami oleh sistem perakaran tanaman. Kondisi O2 yang terbatas ini mempengaruhi pertumbuhan, perkembangan, dan kelangsungan hidup tanaman. Salah satu respons terbaik tanaman terhadap genangan air tanah adalah beralih dari metabolisme respirasi aerobik kepada respirasi fermentasi anaerob. Kenyataannya, kebanyakan protein yang terbentuk selama kondisi hipoksia adalah enzim-enzim yang terlibat dalam pembentukan jalur fermentasi ini. Karena sel tanaman perlu menjaga pasokan ATP secara terus menerus, maka penggunaan akseptor elektron alternatif dan/atau jalur alternatif merupakan elemen kunci untuk bertahan hidup dalam kondisi tergenang air tanah. Respons tanaman dapat juga berupa menurunnya konduktansi stomata dan fotosintesis, serta konduktivitas hidrolik akar. Perubahan fisiologis ini pada gilirannya mempengaruhi cadangan dan translokasi karbohidrat. Kenyataannya, penggunaan karbohidrat yang efisien bisa menjadi pembeda antara spesies yang toleran dan yang tidak toleran. Adaptasi lain yang diamati adalah perubahan morfologi yang terdiri dari pembentukan lentisel hipertrofi, inisiasi akar adventif dan/atau perkembangan aerenkhima. Pengetahuan kita tentang mekanisme adaptasi dasar tanaman terhadap genangan air diperoleh dari pendekatan genomik dan proteomika. Namun, beragamnya respons adaptasi yang terjadi merupakan kesulitan ketika mempelajari masalah stres ini. Tinjauan ini mengulas pemahaman kita mengenai respons metabolis, fisiologis, dan morfologi dan adaptasi tanaman terhadap genangan air.
Kata kunci: anoxia, adaptasi, hipoksia, akar, tanah genangan air
Singkatan: ABA, Asam abscissic; ADH, Alkohol dehidrogenase; ANPs, Protein anaerob; Eh, Potensial redoks; Hb, Hemoglobin; IAA, Auksin; LDH, Dehidrogenase laktat; Lp, Konduktivitas hidrolik; NO, Oksida nitrat; PDC, Piruvat dekarboksilase; PIPs, plasma membran intrinsicproteins
PENDAHULUAN
Genangan air tanah telah lama diidentifikasi sebagai stres abiotik utama dan kendala yang diberikannya pada akar memiliki pengaruh yang signifikan terhadap pertumbuhan dan perkembangan tanaman. Bila peristiwa ini terjadi pada musim semi, maka genangan air ini dapat mengurangi perkecambahan benih dan perkembangan bibit. Dengan demikian, genangan air merupakan faktor penting yang mempengaruhi pertumbuhan, perkembangan dan kelangsungan hidup spesies tanaman, tidak hanya pada ekosistem alami, tetapi juga pada sistem pertanian dan hortikultura (Dat et al. 2006).
Setelah penggenangan, terjadi perubahan yang cepat pada sifat tanah. Pada saat air memenuhi pori-pori tanah, udara didesak keluar, difusi gas berkurang dan senyawa beracun terakumulasi akibat kondisi anaerobik. Semua perubahan ini sangat mempengaruhi kemampuan tanaman untuk bertahan hidup. Sebagai responsnya, resistensi stomata meningkat, fotosintesis dan konduktivitas hidrolik akar menurun, dan translokasi fotoassimilat berkurang. Namun demikian, salah satu adaptasi terbaik tanaman terhadap hipoksia/anoksia adalah peralihan proses biokimia dan metabolisme yang umum terjadi pada saat ketersediaan O2 terbatas (Dat et al. 2004). Sintesis yang selektif satu set dari sekitar 20 protein stres anaerobik (ANPS) memungkinkan terjadinya proses metabolisme penghasil energi tanpa oksigen di bawah kondisi yang anaerob (Subbaiah dan Sachs 2003). Adaptasi lain yang diamati adalah perubahan morfologi yang terdiri dari pembentukan lentisel hipertrofi, inisiasi akar adventif dan/atau perkembangan aerenchyma (Vartapetian dan Jackson 1997, Jackson dan Colmer 2005; Folzer et al., 2006). Tinjauan ini merinci respons stres tanaman yang beragam terhadap hipoksia/anoksia, yang disebabkan oleh genangan air tanah/banjir dan mengkaji beberapa fitur kunci dari adaptasi metabolisme, fisiologis dan morfologis.
PERUBAHAN LINGKUNGAN AKAR SELAMA PENGGENANGAN
Pada saat air menggenangi tanah, ruang udara dipenuhi air, mengakibatkan terjadinya perubahan karakteristik beberapa fisiko-kimia tanah (Kirk et al 2003; Dat et al.2004). Hal pertama yang terjadi sebenarnya adalah adanya peningkatan H2O: tanah jenuh air ciri dari banjir. Namun demikian, mekanisme yang memicu respons tanaman adalah produk dari banjir zona akar (perubahan redoks dan pH tanah, dan penurunan kadar O2).
Potensial redoks (Eh) tanah sering dianggap sebagai indikator yang paling tepat dari perubahan kimia yang terjadi saat banjir (Pezeshki dan Delaune 1998). Eh umumnya menurun selama tergenang air tanah (Pezeshki dan Delaune 1998; Pezeshki 2001, Boivin et al 2002; Lu et al 2004). Potensial redoks tidak hanya merupakan indikator dari kadar O2 (Eh sekitar +350 mV dalam kondisi anaerob) Pezeshki dan De Laune 1998) karena kondisi reduktif menyebabkan kompetisi tinggi akan O2, tetapi juga mempengaruhi ketersediaan dan konsentrasi pelbagai nutrisi tanaman ( Pezeshki 2001). Akan tetapi, perubahan Eh dipengaruhi oleh bahan organik serta Fe dan Mn (Lu et al 2004.). Reduksi tanah memacu pelepasan kation dan fosfor melalui adsorpsi ion besi dan pelarutan oksida (Boivin et al. 2002). Kondisi tanah yang reduktif juga mendukung produksi etanol, asam laktat, asetaldehida, dan asam asetat dan formiat.
Karakteristik kimia tanah lainnya yang sangat dipengaruhi oleh kondisi genangan adalah pH tanah, yang berkorelasi negatif dengan Eh (Singh 2001; Zarate-Valde et al 2006). PH tanah umumnya cenderung meningkat menuju netral pada kondisi tergenang air (Lu et al. 2004). Peningkatan pH dapat dijelaskan oleh pelarutan karbonat dan bikarbonat di awal genangan (Lu et al. 2004). PH tanah juga mempengaruhi perombakan bahan organik tanah dan proses seperti mineralisasi, nitrifikasi, dan hidrolisis urea (Probert dan Keating 2000).
Secara keseluruhan, salah satu efek utama genangan air adalah rendahnya keberadaan O2 di bagian tanaman yang terendam, karena gas O2 berdifusi 10.000 lebih cepat di udara dibandingkan di dalam air. Pengaruh terbatasnya O2 pada metabolisme sel tergantung pada konsentrasinya dan penurunan ketersediaan O2 secara gradual pada akar memiliki berbagai pengaruh pada metabolisme tanaman: i) normoxia memungkinkan respirasi aerobik dan metabolisme normal dan sebagian besar ATP dihasilkan melalui fosforilasi oksidatif, ii) hipoksia terjadi ketika penurunan O2 yang tersedia mulai menjadi faktor pembatas untuk produksi ATP melalui fosforilasi oksidatif dan, iii) anoxia ketika ATP hanya dihasilkan melalui glikolisis fermentasi, karena tidak ada O2 yang tersedia lagi. Dengan demikian, karena kondisi anaerobik berkembang di tanah tergenang air, maka ada peningkatan jumlah produk sampingan dari metabolisme fermentasi yang terakumulasi di lingkungan perakaran dan kadar CO2, metana, dan asam lemak volatile meningkat (Pezeshki 2001). Penurunan energi yang tersedia memiliki konsekuensi yang dramatis pada proses seluler, yang menyebabkan ketidakseimbangan dan/atau kekurangan air dan hara nutrisi (Dat et al. 2006). Selain itu, perubahan lingkungan ini juga dapat membuat tanaman lebih rentan terhadap stres lainnya, khusus terhadap infeksi patogen (Munkvold dan Yang 1995, Yanar et al 1997;Balerdi et al.2003).
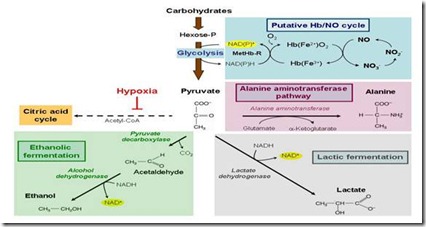
Gambar 1. Skema diagram jalur metabolik utama yang dusulkan pada saat tanaman mengalami stres genangan.
Hipoksia menyebabkan penurunan respirasi mitokondria, yang sebagian dikompensasi oleh peningkatan baik pada glikolisis maupun pada fermentasi. Nitrat telah diusulkan sebagai akseptor elektron perantara ketika konsentrasi O2 rendah dan mungkin ikut serta pada oksidasi NAD(P)H selama hipoksia (Igamberdiev et al.2005). NO dapat dioksigenasi menjadi nitrat dengan O2 yang terikat erat pada hemoglobin kelas-1 [Hb(Fe2+)O2], yang dioksidasi menjadi metHb[Hb(Fe3+)]. Enzim alanin aminotransferase yang mengubah piruvat menjadi alanin banyak diinduksi dalam kondisi hipoksia. Namun, tidak seperti pembentukan etanol, tidak ada konsumsi NAD(P)H dalam proses ini (Gibbs dan Greenway 2003) MetHb-R: methemoglobin reduktase; NO: nitrat oksida.
RESPONS METABOLISME DAN ADAPTASI TERHADAP HIPOKSIA DAN ANOKSIA
Akibat langsung dari genangan air adalah periode hipoksia, diikuti oleh penurunan tajam dari O2 yang menyebabkan kondisi anoksia (Blom dan Voesenek 1996). Kekurangan oksigen seluler disebut "hipoksia" ketika kadar oksigen membatasi respirasi mitokondria dan “anoksia” saat respirasi benar-benar terhambat. Ketika respirasi menurun, aliran elektron melalui jalur respirasi berkurang, sehingga mengurangi produksi ATP. Akibatnya, bahan kimia pengoksidasi (yaitu nicotinamide adenin dinukleotida, NAD) harus dihasilkan melalui jalur alternatif yang tidak menggunakan O2 sebagai akseptor elektron terminal (Roberts et al 1984; Drew et al 1994; Drew 1997; Summers et al 2000) . Ketika fosforilasi oksidatif adenosine difosfat (ADP) terbatas, maka tanaman mengubah metabolismenya dari respirasi aerobik menjadi fermentasi anaerob (Gambar 1) (Peng et al 2001; Fukao dan Bailey-Serres 2004). Jalur fermentasi anaerob berfungsi sebagai rute metabolisme aman dan mencakup dua tahap: karboksilasi piruvat menjadi asetaldehida (dikatalisis oleh piruvat dekarboksilase, PDC) dan berikutnya reduksi asetaldehida menjadi etanol dengan diiringi oksidasi NAD (P) H menjadi NAD (P), dikatalisis oleh alkohol dehidrogenase (ADH) (Vartapetian dan Jackson 1997, Kingston-Smith dan Theodorou 2000;. Nakazono et al 2000). Jalur metabolisme fermentasi hanya memungkinkan sintesis 2 mol ATP dibandingkan 36 ATP per mol glukosa yang dihasilkan pada respirasi aerobik. Untuk mengimbangi defisit energi, glikolisis dipercepat, menyebabkan menipisnya cadangan karbohidrat ("Pasteur efek"). Tidak mengherankan, enzim yang berperan dalam jalur fermentasi (lihat PDC dan ADH di atas) termasuk kelompok dari sekitar 20 ANPS, diinduksi secara selektif selama stres hipoksia, sedangkan keseluruhan sintesis protein berkurang (Sachs et al.1980;. Chang et al 2000). ANPS yang diinduksi dalam kondisi hipoksia adalah enzim glikolisis, fermentasi etanol, proses yang terkait dengan metabolisme karbohidrat, tetapi juga yang lainnya yang terlibat dalam pembentukan aerenchyma (xyloglucans endotransglycosylase) dan pengendali pH sitoplasma (Vartapetian 2006).
Spesies yang toleran terhadap genangan air umumnya dianggap yang mampu mempertahankan status energinya melalui fermentasi. Selain kemampuannya untuk menjaga tingkat energi yang tepat, pemeliharaan pH sitosol sangat penting. Ketika hipoksia atau anoksia terjadi, pH sitoplasma menunjukkan penurunan awal yang dikaitkan dengan produksi awal asam laktat melalui fermentasi. Menurut "teori pH-stat Davies-Roberts", penurunan pH memungkinkan pengalihan dari laktat ke fermentasi etanol dengan menghambat laktat dehidrogenase (LDH) dan aktivasi ADH (Chang et al. 2000). Karena asidosis dapat menginduksi nekrosis sel, pengalihan yang terjadi dapat mempertahankan pH di sekitar 6,8, sehingga memungkinkan kelangsungan hidup sel. Meskipun hipotesis ini telah diverifikasi pada beberapa kasus, ada banyak laporan yang mempertanyakan model ini (Tadege et al. 1998; Kato-Noguchi 2000b). Memang, jelaslah sekarang bahwa korelasi antara laktat dengan asidifikasi sitoplasma tidak ubiquitus pada semua jaringan tanaman yang dipelajari (Felle 2005).
Karena O2 kurang dalam kondisi hipoksia, maka ia harus diganti dengan akseptor elektron alternatif. Bahkan, nitrat telah lama dianggap sebagai akseptor elektron terminal bagi mitokondria tanaman di bawah kondisi hipoksia atau anoxia (Vartapetian dan Polyakova 1998; Vartapetian et al 2003). Baru-baru ini reduksi nitrat telah diteliti sebagai jalur respirasi alternatif dan ini menjadi sangat penting untuk pemeliharaan redoks dan homeostasis energi sel dalam kondisi oksigen yang terbatas (Igamberdiev dan Hill 2004). Urutan reaksinya, yang disebut sebagai siklus Hb/NO di mana NO (nitrat oksida) dioksidasi menjadi nitrat, melibatkan hemoglobin non-simbiosis kelas 1 yang diinduksi dalam kondisi hipoksia (Gambar 1) (Dordas et al.2003 , 2004, Perazzolli et al. 2004; Parent et al. 2008a). Postulat Siklus Hb/NO baru-baru ini didemostrasikan pada akar hipoksia dan selain penting bagi respons tanaman terhadap genangan, ia juga memainkan peran di awal perkecambahan benih (Hebelstrup et al.2007)
RESPONS FISIOLOGIS TERHADAP GENANGAN
Salah satu respons fisiologis awal tanaman terhadap genangan adalah pengurangan konduktansi stomata (Gambar 2) (Sena Gomes dan Kozlowski 1980; Pezeshki dan Chambers 1985; Folzer et al 2006). Genangan tidak hanya meningkatkan resistensi stomata tetapi juga membatasi penyerapan air, sehingga kemudian mengarah kepada defisit air internal (Jackson dan Hall 1987, Ismail dan Noor 1996, Pezeshki et al 1996;. Pezeshki 2001, Nicolas et al 2005;Folzer et al 2006; Parent et al 2008a).
Rendahnya kadar O2 juga dapat mengurangi konduktivitas hidrolik (Lp) akibatnya kepada penurunan permeabilitas akar (Clarkson et al. 2000; Else et al. 2001.). Penurunan Lp bisa dihubungkan dengan molekul aquaporin oleh pH sitosol (Tournaire-Roux et al. 2003). Bukti menunjukkan bahwa regulasi protein membran plasma intrinsik (PIPs) oleh pH sangat relevan pada kondisi anoksia (Postaire et al.2007), sebagai residu histidin cadangan pada posisi 197 di Loop D intraseluler telah diidentifikasi sebagai tempat pH-sensing utama dalam kondisi fisiologis (Tournaire-Roux et al.2003; Kaldenhoff dan Fischer 2006; Secchi et al 2007). Kenyataannya, pengaturan gen aquaporin umumnya dikaitkan dengan penurunan Lp akar karena aquaporins mengendalikan pergerakan air radial dalam akar (Utara et al 2004;. Vandeleur et al 2005.). Dengan demikian, tampaknya bahwa rendahnya Lp di seluruh tanaman pada kondisi tergenang air kemungkinan besar terkait dengan hambatan transportasi air oleh aquaporin, meskipun studi mendalam tentang pengaruh aquaporin terhadap pengaturan ke seluruhan tata air tanaman selama tergenangan air masih kurang. Selain itu, rendahnya pergerakan air radial sebagian dapat dijelaskan oleh adanya gradien oksigen antar bagian dalam jaringan akar. Sesungguhnya, ada bukti yang jelas bahwa dalam tanah yang tergenang air, ada gradien O2 antara stele yang mungkin dalam kondisi anoksia, dengan sel-sel kortek yang mungkin hanya dalam kondisi hipoksia (Thomson dan Greenway 1991; Colmer 2003). Dengan demikian, perbedaan-perbedaan ini dalam lingkungan mikro juga dapat menyebabkan perbedaan antar bagian pada tingkat energi sel dan kemudian rendahnya Lp akar.
Kekurangan O2 umumnya menyebabkan sangat cepat berkurangnya laju fotosintesis pada tanaman yang tidak toleran genangan, yang umumnya dianggap sebagai hasil dari berkurangnya mulut stomata (Huang et al, 1997;. Gravatt dan Kirby 1998; Pezeshki dan Delaune 1998;. Malik et al 2001). Faktor-faktor lain seperti penurunan kadar klorofil daun, penuaan dini daun, dan penurunan luas daun juga dapat menyebabkan penghambatan fotosintesis pada tahap berikutnya (Sena Gomes dan Kozlowski 1980; Cao dan Conner 1999). Ketika berkepanjangan, stres dapat menyebabkan penghambatan aktivitas fotosintesis pada jaringan mesofil (Huang et al 1994; Liao dan Lin 1994; Pezeshki et al 1996), serta penurunan aktivitas metabolik dan translokasi fotoasimilat ( Pezeshki 1994; Drew 1997, Pezeshki 2001, Sachs dan Vartapetian 2007). Dampak dari berkurangnya fotosintesis pada pertumbuhan dan perkembangan tanaman bisa jadi sangat dramatis dan secara bersamaan dapat menyebabkan disfungsi fisiologis seperti penghambatan transportasi air dan perubahan keseimbangan hormon (Vuylsteker et al 1998; Kato-Noguchi 2000a; Else et al 2001; Gunawardena et al 2001). Untuk mempertahankan aktivitas metaboliknya, tanaman harus menggunakan cadangan karbohidratnya. Karena pasokan karbohidrat awal berkorelasi dengan tingkat toleransi terhadap hipoksia/anoksia pada banyak spesies, mungkin melalui keterlibatan dalam menyediakan energi selama kondisi anaerobik, maka tingkat cadangan karbohidrat menjadi faktor penting dari toleransi terhadap genangan dalam jangka panjang (Setter et al.1997; Ram et al 2002). Sebagai contoh, peningkatan kemampuan untuk memanfaatkan gula melalui jalur glikolisis memungkinkan bibit padi untuk bertahan hidup lebih lama dalam genangan (Ito et al. 1999).
Meskipun tanaman memiliki cadangan gula tinggi, namun cadangan gulanya harus tersedia dan mudah dikonversi melalui jalur glikolisis yang efisien. Kenyataannya, ketersediaan fotoassimilat bagi sel pada kondisi anaerobik telah diusulkan sebagai salah satu tahap pembatas bagi tanaman untuk bertahan hidup dalam kondisi tergenang (Pezeshki 2001). Sesungguhnya, tanah yang tergenang air cenderung mengurangi translokasi produk fotosintesis dari "source" daun kepada "sink" akar (Barta dan Sulc 2002, Yordanova et al. 2004). Dengan demikian, pemeliharaan aktivitas fotosintesis dan akumulasi gula terlarut ke akar jelaslah merupakan adaptasi penting terhadap genangan air (Chen et al. 2005).
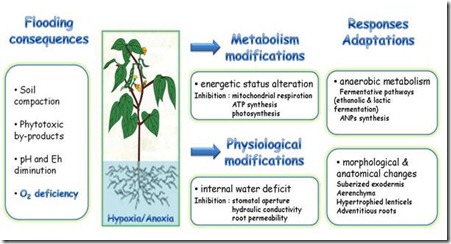
Gambar 2. Keadaan fisiko-kimia utama yang terjadi pada rizosfer selama tergenang air dan perubahan metabolisme dan fisiologis yang diiukti oleh inisiasi respons adaptasi.
ADAPTASI MORFOLOGI DAN ANATOMI TERHADAP GENANGAN
Terbentuknya lentisel hipertrofi merupakan perubahan anatomi umum yang diamati pada pelbagai spesies tanaman berkayu selama tergenang (Gambar 3) (Yamamoto et al.1995, Kozlowski 1997). Pertumbuhan hipertrofi terlihat sebagai pembengkakan jaringan di dasar batang dan diyakini merupakan hasil dari pembelahan dan pembesaran sel radial. Fenomena ini telah lama dikaitkan dengan keberadaan auksin (IAA) dan produksi etilen (Blake dan Reid 1981; Kozlowski 1997). Perkembangan lentisel hipertrofi ini diyakini untuk memfasilitasi difusi O2 ke arah bawah dan menjadi ventilasi potensial bagi senyawa yang diproduksi di akar sebagai produk samping dari metabolisme anaerobik (etanol, CH4, CO2). Meskipun masih belum ada konsensus yang jelas mengenai peran fisiologis yang sebenarnya, jumlah lentisel ini telah dikaitkan dengan meningkatnya toleransi terhadap genangan pada spesies Quercus (Colin-Belgrand et al. 1991; Parelle et al.2006b). Selain itu, lentisel hipertrofi cenderung lebih berkembang di bawah permukaan air (Tang dan Kozlowski 1982; Parelle et al. 2006a) yang tidak mendukung perannya sebagai fasilitator penting bagi masuknya dan pengiriman O2 kepada sistem perakaran, sebagaimana yang diasumsikan. Dengan demikian lebih mungkin bahwa lentisel sebenarnya membantu mempertahankan homeostasis air saat tergenang, dengan cara menggantikan sebagian sistem akar yang membusuk dan memberikan sarana pengambilan air bagi tunas. Untuk mendukung peran tersebut, lentisel permeabel terhadap air (Groh et al. 2002), adanya kecenderungan konduktansi stomata untuk kembali menuju tingkat yang terkontrol setelah penurunan sementara secara umum telah dikaitkan dengan perkembangan lentisel hipertrofi ini (Pezeshki 1996, Gravatt dan Kirby 1998; Folzer et al. 2006), dan kehadiran mereka dikaitkan dengan pemeliharaan status air tanaman selama stres genangan pada spesies Quercus (Parent et al. 2008a). Dengan demikian, meskipun fungsi mereka masih belum begitu jelas, tampaknya lentisel mungkin memainkan peran penting dalam adaptasi terhadap kondisi genangan pada beberapa spesies dengan cara membantu mempertahankan homeostasis air tanaman.
Adaptasi morfologi penting lainnya terhadap genangan adalah perkembangan akar adventif (Gambar 3), yang berfungsi menggantikan akar utama (Bacanamwo dan Purcell 1999; Gibberd et al. 2001, Malik et al. 2001). Pembentukan akar khusus ini terjadi ketika sistem perakaran asli tidak mampu memasok air dan mineral yang dibutuhkan tanaman (Mergemann dan Sauter 2000). Selain itu, membusuknya sistem akar utama dapat dianggap sebagai pengorbanan untuk memungkinkan penggunaan energi yang lebih efisien bagi pengembangan sistem akar yang lebih sesuai (Dat et al. 2006).
Akar adventif biasanya terbentuk di dekat pangkal batang atau di wilayah di mana lentisel berlimpah, dan pertumbuhan mereka adalah lateral, sejajar dengan permukaan air/tanah. Kehadiran akar adventif di perbatasan antara permukaan tanah jenuh air dengan atmosfir mencerminkan pentingnya akar ini dalam menggantikan sistem akar yang normal baik di dalam air maupun jauh di permukaan air tanah. Selain itu, kemampuan untuk memproduksi akar adventif umumnya terkait dengan meningkatknya toleransi terhadap genangan dan perkembangan akar adventif ini telah banyak dikaitkan dengan produksi etilen (Voesenek et al 1993; Mergemann dan Sauter 2000;. Steffens et al 2006). Baru-baru ini, molekul lainnya telah diidentifikasi sebagai pemain kunci dalam inisiasi akar adventif ini (Pagnussat et al, 2002; 2003; 2004). Sesungguhnya, data terakhir menunjukkan bahwa produksi NO bekerja searah dengan IAA dalam pengendalian pembentukan akar adventif. Namun, pemahaman tentang peran NO dalam pembentukan akar adventif masih dini dan temuan mengenai peran penting NO terhadap toleransi stres genangan ada di masa depan.
Terakhir, salah satu respons yang paling penting terhadap genangan air adalah terbentuknya ruang kosong (aerenkhima) pada korteks akar (Gambar 3). Terbentuknya aerenkhima ini mungkin merupakan respons terhadap genangan baik pada spesies yang toleran maupun yang tidak toleran (Vartapetian dan Jackson 1997, Schussler dan Longstreth 2000, Chen et al 2002;. Evans 2004). Akan tetapi, pembentukan aerenchyma merupakan respons adaptif pada spesies toleran genangan saja, khususnya pada spesies berkayu lahan basah (Kludze et al 1994; Pezeshki 1996). Peningkatan porositas dapat meningkatkan ventilasi pada bagian atas tanaman dan pengudaraan senyawa beracun yang diproduksi di akar (misalnya, etanol, metana) (Visser et al 1997;Visser dan Pierik 2007) dan/atau meningkatkan difusi longitudinal gas pada akar sehingga meningkatkan aerasi (Laan et al 1991; Evans 2004). Ternyata, proporsi aerenkhima umumnya dianggap sebagai faktor pembeda utama antara tumbuhan lahan basah dan tumbuhan bukan lahan basah (Vasellati et al. 2001).
Terbentuknya jaringan aerenkhima atau ruang kosong ini tidak hanya pada akar saja. Jaringan ini juga terlihat pada seludang daun ketika terendam air dan membentuk sistem interkoneksi ventilasi tunas-akar (Jackson dan Armstrong, 1999; Fabbri et al 2005). Aerenkhima meningkatkan porositas jaringan yang dapat terbentuk dengan sendirinya sebagai akibat dari perubahan yang terkait dengan tekanan osmotik dari bentuk sel (Gambar 3) (Justin dan Armstrong 1987; Folzer et al. 2006). Perubahan bentuk sel dan bongkahannya pada korteks akar sangat mungkin terkait dengan meningkatnya aktivitas enzim pelunak dinding sel dan dengan deposit suberin pada eksodermis (Colmer 2003, De Simone et al 2003; Armstrong dan Armstrong 2005; Enstone dan Peterson 2005) .
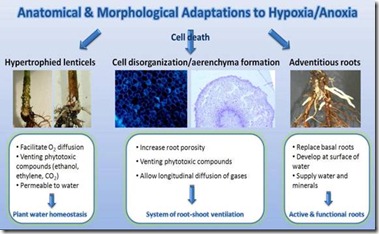
Gambar 3. Adaptasi anatomi dan morfologi yang terjadi selama tanaman tergenang air
Terbentuknya eksodermis yang bersuberin berkorelasi dengan terbentuknya aerenkhima pada jagung (Enstone dan Peterson 2005) dan berhubungan dengan berkurangnya kehilangan O2 akar (Visser et al., 2000; Armstrong dan Armstrong 2005). Adanya penghalang di permukaan korteks itu bisa jadi tidak hanya mengurangi kehilangan O2 ke rhizosfer, tetapi juga dapat melindungi tanaman dari fitotoksin yang dihasilkan oleh mikroorganisme di sekitar akar (Soukup et al, 2002; Armstrong dan Armstrong 2005; Soukup et al. 2007).
Proses perkembangan aerenkhima telah lama diteliti dan sekarang telah jelas bahwa setidaknya ada dua jenis proses yang terlibat. Yang pertama adalah perkembangan konstitutif, yang terjadi baik pada tumbuhan yang tergenang air maupun tidak. Proses ini terbentuk oleh sel yang memisah selama perkembangan jaringan. Tipe kematian sel yang berlangsung melalui sel yang memisahkan diri ini disebut schizogeny (dibentuk oleh pemisahan sel) dan perkembangannya diatur dan tidak terkait dengan rangsangan dari luar. Ini adalah hasil dari pola khusus jaringan yang sangat teratur dari pemisahan sel. Jenis lain dari proses kematian sel disebut lysogeny (dibentuk oleh kerusakan parsial dari korteks), yang menyerupai kematian sel yang terprogram, biasanya terlihat pada saat respons hipersensitif dari interaksi patogen-tumbuhan (Mittler et al, 1997; Induk et al 2008b.) dan lebih baru lagi diidentifikasi pada saat cekaman abiotik lainnya (Pellinen et al.1999; Dat et al 2001; Dat et al 2003; Van Breusegem dan Dat 2006). Proses kematian sel aktif yang berlangsung selama pembentukan aerenkhima dikendalikan secara genetik dan menunjukkan banyak kesamaannya dengan apoptosis, meskipun ada banyak bukti bahwa hal itu umumnya kurang memiliki beberapa fitur dari kematian sel apoptosis (Buckner et al. 2000). Sebagai contoh, pada tumbuhan Sagittaria lancifolia, perubahan inti (penggumpalan kromatin, fragmentasi, gangguan membran inti), adalah peristiwa yang paling awal terjadi, setelah tergenang air. Perubahan inti ini diikuti oleh membran plasma menjadi keriting, disintegrasi tonoplas, pembengkakan dan gangguan organela, hilangnya isi sitoplasma dan hancurnya sel (Schussler dan Longstreth 2000). Urutan kejadian ini tampaknya umum terjadi pada sebagian besar spesies yang dipelajari, meskipun waktu gangguan tonoplas bervariasi (Schussler dan Longstreth 2000).
KESIMPULAN
Bahasan ringkas ini mengulas pemahaman kita tentang respons biokimia, fisiologis dan morfologi tumbuhan terhadap genangan. Perubahan yang terjadi pada zona akar dan penerimaannya oleh tumbuhan merupakan hal penting bagi terbentuknya respons yang tepat. Perubahan difusi gas, lingkungan kimia tanah (pH, Eh) dan akumulasi produk samping beracun dari proses anaerobik, ditambah dengan menurunnya kadar O2 jelaslah merupakan kunci bagi kemampuan tumbuhan untuk mengatur respons yang tepat. Gejala-gejala adaptasi meliputi perubahan metabolisme yang dapat membantu mempertahankan integritas sel tanaman. Meskipun kurang efisien dibanding proses aerobik, lintasan fermentasi anaerobik dapat mempertahankan pH sel dan juga homeostasis ATP. Selain lintasan glikolisis ke laktat dan etanol, reduksi nitrat dapat digunakan sebagai lintasan alternatif untuk membantu mempertahankan homeostasis redoks dan energi pada kondisi hipoksia dan anoksia. Gejala lainnya seperti cadangan karbohidrat yang lebih tinggi dan/atau penggunaannya yang efisien, mempertahankan fotosintesis dan status air tanaman melalui pemanjangan batang/tunas atau molekul aquaporin dapat sangat meningkatkan kelangsungan hidup tanaman yang terendam air. Akhirnya, perubahan morfologi seperti pembentukan lentisel, perkembangan aerenkhima, inisiasi akar adventif dan/atau suberisasi akar tidak hanya dapat memperbaiki tingkat difusi O2 ke titik tumbuh tumbuhan yang tergenang tetapi juga membantu meringankan kekurangan air dan unsur hara. Sebagian besar gejala adaptasi ini telah diidentifikasi dengan baik pada spesies model yang beradaptasi dengan kondisi tergenang seperti jagung, padi dan carex, namun peran yang tepat dari lentisel serta proses molekuler yang terlibat dalam pembentukan aerenkhima masih perlu dipelajari lebih lanjut. Selain itu, pemahaman kita tentang respons adaptasi spesies berkayu yang membentuk ekosistem hutan masih dini sekali.
UCAPAN TERIMA KASIH
Penulis berterima kasih kepada the Conseil Regional de Franche Comte atas bantuan dana. C Parent adalah penerima beasiswa doctor dari the «Ministиre de l’Education Nationale, de la Recherche et de laTechnologie».
DAFTAR PUSTAKA
Armstrong J, Armstrong W (2005) Rice: Sulfide-induced barriers to root radial oxygen loss, Fe2+ and water uptake, and lateral root emergence.Annals of Botany 96, 625-638
Bacanamwo M, Purcell LC (1999) Soybean dry matter and N accumulation responses to flooding stress, Nsources and hypoxia. Journal of Experimental Botany 50, 689-696
Balerdi CF, Crane JH, Schaffer B (2003) Managing your tropical fruit grove under changing watertable levels. Fact Sheet HS 957, 1-5
Barta AL, Sulc RM (2002) Interaction between waterlogging injury and irradiance level inalfalfa. Crop Science 42, 1529-1534
Blake TJ, Reid DM (1981) Ethylene, waterrelations andtolerance to waterlogging of three Eucalyptusspecies.Australian Journal of Plant Physiology 8,497-505
Blom CW, Voesenek LA (1996) Flooding: The survival strategies of plants. Tree Physiology 11, 290-295
Boivin P, Favre F, Hammecker C, Maeght JL, Delariviиre J, Poussin JC, Wopereis MCS (2002)Processes driving soil solution chemistry in a flooded rice-cropped vertisol: Analysis of long-time monitoring data. Geoderma 110,87-107
Buckner B, Johal GS, Janick-Buckner D (2000) Cell deathinmaize. Physiologia plantarum 108, 231-239 Cao FL, Conner WH (1999) Selection of flood-tolerant Populus deltoides clones for reforestation projects in China. Forest Ecology and Management 117, 211-220
Chang WP, Huang L, Shen M, Webster C, Burlingame AL, Roberts JK (2000) Patterns of protein synthesis and tolerance of anoxia in root tips of maize seedlings acclimated to a low-oxygen environment, and identification of proteinsby mass spectrometry. Plant Physiology 122, 295-318
Chen H, Qualls R, Blank R (2005) Effect of soil flooding on photosynthesis, carbohydrate partitioning and nutrient uptake in theinvasiveexotic Lepidium latifolium Aquatic Botany 82, 250-268
Chen H, Qualls R, Miller G (2002)Adaptive responses of Lepidium latifolium to soil flooding: Biomass allocation,adventitious rooting, aerenchyma formation and ethylene production. Environmental and Experimental Botany 48,119-128
Clarkson DT, Carvajal M, Henzler T, Waterhouse RN, Smyth AJ, Cooke DT, Steudle E (2000) Root hydraulic conductance: Diurnal aquaporin expression and the effects of nutrient stress. Journal of Experimental Botany 51,61-70
Colin-Belgrand M, Dreyer E, Biron P (1991) Sensitivity of seedlings from different oak species to waterlogging: Effects on root growth and mineral nutrition Annales des Sciences Forestieres 48, 193-204
Colmer TD (2003) Long-distance transport of gases in plants: A perspective on internal aeration and radial oxygen loss from roots. Plant, Cell and Environment 26, 17-36
Dat J, Capelli N, Folzer H, Bourgeade P, Badot P-M (2004) Sensing and signaling during plantflooding. Plant Physiology and Biochemistry 42, 273-282
Dat J, Folzer H, Parent C, Badot P-M, Capelli N (2006) Hypoxiastress:Current Understanding and Perspectives. In: Teixeira da Silva JA (Ed) Floriculture, Ornamental and Plant Biotechnology: Advances and Topical Issues (Vol 3), Global Science Books, Isleworth, United Kingdom,pp664-674
Dat JF, Inzй D, Van Breusegem F (2001) Catalase-deficient tobacco plants: Tools for in planta studies on therole ofhydrogen peroxide. Redox Report 6, 37-42
Dat JF, Pellinen R, Beeckman T, Van De Cotte B, Langebartels C, Kangasjarvi J, Inzй D, Van Breusegem F (2003) Changes in hydrogen peroxide homeostasis trigger an active cell death process intobacco. Plant Journal 33,621-632
De Simone O, Haase K, Muller E, Junk WJ, Hartmann K, Schreiber L, Schmidt W (2003) Apoplasmic barriers and oxygen transport properties of hypodermal cell walls in roots from four Amazoniantreespecies. Plant Physiology 132, 206-217
Dordas C, Hasinoff B, Rivoal J, Hill R (2004) Class-1 hemoglobins, nitrate and NO levels in anoxicmaizecell-suspension cultures. Planta 219, 66-72
Dordas C, Rivoal J, Hill R (2003) Plant haemoglobins, nitricoxide and hypoxic stress. Annals of Botany 91, 173-178
Drew M (1997) Oxygen deficiency and root metabolism: Injury and acclimation under hypoxia and anoxia. Annual Review Plant Physiology and Plant Molecular Biology 48, 223-250
Drew MC, Cobb BG, Johnson JR, Andrews D, Morgan PW, Jordan W, Jiu HC (1994) Metabolic acclimationof root tips tooxygen deficiency. Annals of Botany 74, 281-286
Else MA, Coupland D, Dutton L, Jackson MB (2001) Decreased root hydraulic conductivity reduces leaf water potential, initiates stomatal closure and slows leaf expansion in flooded plants of castor oil (Ricinus communis) despitediminisheddelivery of ABA from the roots to shoots in xylem sap. Physiologia Plantarum 111, 46-54
Enstone DE, Peterson CA (2005) Suberin lamella development in maize seedling roots grown in aerated and stagnant conditions. Plant, Cell and Environment 28, 444-455
Evans DE (2004) Aerenchyma formation. New Phytologist 161, 35-49
Fabbri LT, Rua GH, Bartoloni N (2005) Different patterns of aerenchyma formation in two hygrophytic species of Paspalum (Poaceae) as response to flooding. Flora: Morphology, Distribution, Functional Ecology of Plants 200,354-360
Felle HH (2005)pH regulation in anoxic plants. Annals of Botany 96, 519-532
Folzer H, Dat J, Capelli N, Rieffel D, Badot P-M (2006) Response to flooding of sessile oak: Anintegrativestudy. Tree Physiology 26, 759-766
Fukao T, Bailey-Serres J (2004) Plant responses to hypoxia- is survival a balancing act? Trends in Plant Science 9, 449-456
Gibberd MR, Gray JD, Cocks PS, Colmer TD (2001) Waterloggingtolerance amonga diverse range of Trifolium accessions is related to root porosity, lateral root formation and’aerotropic rooting’. Annals of Botany 88, 579-589
Gibbs J, Greenway H (2003) Mechanisms of anoxia tolerance in plants. I. Growth, survival and anaerobic catabolism. Functional Plant Biology 30, 1-47
Gravatt DA, Kirby CJ (1998) Patterns of photosynthesis and starchallocation in seedlings of four bottomland hardwood tree species subjected to flooding. Tree Physiology 18, 411-417
Groh B, Hubner C, Lendzian KJ (2002) Water and oxygen permeance of phellems isolated from trees: The role of waxes and lenticels. Planta 215,794-801
Gunawardena A, Pearce D, Jackson M, Hawes C, Evans D (2001) Characterisation of programmed cell death during aerenchyma formationinduced by ethylene orhypoxiain roots of maize (Zea mays L.). Planta 212, 205-214 Hebelstrup KH, Igamberdiev AU, Hill RD (2007) Metabolic effects of hemoglobin gene expressioninplants. Gene 398, 86-93
Huang B, Johnson JW, NeSmith DS (1997) Responses to root-zone CO2 enrichment and hypoxia of wheat genotypesdiffering in waterlogging tolerance. Crop Science 37, 464-468
Huang B, Johnson JW, Nesmith S, Bridges DC (1994) Growth,physiological and anatomical responses of two wheat genotypes to waterlogging and nutrient supply. Journal of Experimental Botany 45, 193-202
Igamberdiev A, Hill R (2004) Nitrate, NO and haemoglobin in plant adaptation tohypoxia: an alternativeto classic fermentationpathways. Journal of Experimental Botany 55, 2473-2482
Igamberdiev AU, Baron K, Manac’h-Little N, Stoimenova M, Hill RD (2005) The Haemoglobin/Nitric oxide cycle: Involvement in flooding stress and effects onhormonesignalling. Annals of Botany 96, 557-564
Ismail MR, Noor KM (1996) Growth and physiological processes of young starfruit (Averrhoa carambola L.) plants under soil flooding. Scientia Horticulturae 65, 229-238 Ito O, Ella E, Kawano N (1999) Physiological basis of submergence tolerance in rainfed lowland rice ecosystem. Field Crops Research 64, 75-90
Jackson MB, Armstrong W (1999) Formation of aerenchyma and the processes of plant ventilation in relation tosoil flooding and submergence. Plant Biology 1, 274-287 Jackson MB, Colmer TD (2005) Response and adaptation by plants to flooding stress. Annals of Botany 96, 501-505
Jackson MB, Hall KC (1987) Early stomatal closurein waterlogged pea plants is mediated by abscisic acid inthe absence of foliar water deficits. Plant, Cell and Environment 10, 121-130
Justin SHFW, Armstrong W (1987) The anatomical characteristics of roots and plantresponse to soil flooding. New Phytologist 106, 465-495
Kaldenhoff R, Fischer M (2006) Functional aquaporin diversity in plants. Biochimica and Biophysica Acta – Biomembranes 1758, 1134-1141
Kato-Noguchi H (2000a) Abscisic acid and hypoxicinduction of anoxia tolerance in roots of lettuce seedlings. Journal of Experimental Botany 51, 1939-1944
Kato-Noguchi H (2000b) Evaluation of the importance of lactate for the activation of ethanolic fermentationin lettuce roots inanoxia. Physiologia Plantarum 109, 28-33
Kingston-Smith AH, Theodorou MK (2000) Post-ingestion metabolism of fresh forage. New Phytologist 148, 37-55
Kirk GJD, Solivas JL, Alberto MC (2003) Effects of flooding and redox conditions on solute diffusion in soil. European Journal of Soil Science 54, 617-624
Kludze HK, Pezeshki SR, DeLaune RD (1994) Evaluation of root oxygenation and growth in bald cypressin response to short-termsoilhypoxia. Canadian Journal of Forest Research 24, 804-809
Kozlowski T (1997) Responses of woody plants to flooding and salinity. Tree Physiology Monograph 1, 1-29
Laan P, Clement JMAM, Blom CWPM (1991) Growth and development of Rumex roots as affected by hypoxic and anoxic conditions. Plant and Soil 136, 145-151
Liao CT, Lin CH (1994) Effect of flooding stress on photosynthetic activities of Momordica charantia Plant Physiology and Biochemistry 32. 479-485
Lu Y, Watanabe A, Kimura M (2004)Contribution of plant photosynthates to dissolved organic carbon in a flooded rice soil. Biogeochemistry 71, 1-15
Malik AI, Colmer TD, Lambers H, Schortemeyer M (2001) Changes inphysiological and morphological traits of roots and shoots of wheat in response to different depths of waterlogging. Australian Journal of Plant Physiology 28, 1121-1131
Mergemann H, Sauter M (2000) Ethylene induces epidermal cell death at the site of adventitious rootemergencein rice. Plant Physiology 124, 609-614
Mittler R, Simon L, Lam E (1997) Pathogen-induced programmed cell death in tobacco. Journal of Cell Science 110, 1333-1344
Munkvold GP, Yang XB (1995) Crop damage and epidemics associated with 1993 floods in Iowa.Plant Disease 79, 95-101
Nakazono M, Tsuji H, Li Y, Saisho D, Arimura S-I, Tsutsumi N, Hirai A (2000) Expression of a gene encoding mitochondrial aldehyde dehydrogenase in rice increases under submerged conditions. Plant Physiology 124, 587-598
Nicolas E, Torrecillas A, Dell’Amico J, Alarcon JJ (2005) The effect of shortterm flooding on the sap flow, gas exchange and hydraulic conductivity of young apricot trees. Trees – Structure and Function 19, 51-57
North GB, Martre P, Nobel PS (2004) Aquaporins account for variations in hydraulic conductance for metabolically active root regions of Agave deserti in wet, dry, and rewetted soil. Plant, Cell and Environment 27, 219-228
Pagnussat GC, Lanteri ML, Lamattina L (2003) Nitric oxide and cyclic GMP are messengers in the indole acetic acid-induced adventitious rooting process. Plant Physiology 132, 1241-1248
Pagnussat GC, Lanteri ML, Lombardo MC, Lamattina L (2004) Nitricoxide mediates the indole acetic acid induction activation of a mitogen-activated protein kinase cascade involved in adventitious root development. Plant Physiology 135, 279-286
Pagnussat GC, Simontacchi M, Puntarulo S, Lamattina L (2002) Nitric oxide is required for root organogenesis. Plant Physiology 129, 954-956
Parelle J, Brendel O, Bodenes C, Berveiller D, Dizengremel P, Jolivet Y, Dreyer E (2006a) Differences in morphological and physiological responses to water-logging between two sympatric oak species (Quercus petraea [Matt.] Liebl., Quercus robur L.). Annals of Forest Science 63, 849-859
Parelle J, Roudaut J-P, Ducrey M (2006b) Light acclimation and photosynthetic response of beech (Fagus sylvatica L.) saplings underartificial shading or natural Mediterranean conditions. Annals of Forest Science 63, 257-266
Parent C, Berger A, Folzer H, Dat J, Crиvecoeur M, Badot P-M, Capelli N (2008a) A novel nonsymbiotichemoglobin from oak: Cellular and tissue specificity of gene expression. New Phytologist 177, 142-154
Parent C, Capelli N, Dat J (2008b) Reactive oxygen species, stress and cell death in plants. Comptes Rendus – Biologies 331, 255-261
Pellinen R, Palva T, Kangasjarvi J (1999) Subcellular localization of ozone-induced hydrogen peroxide production in birch (Betula pendula) leaf cells. The Plant Journal 20, 349-356
Peng H-P, Chan C-S, Shih M-C, Yang SF (2001) Signaling events in the hypoxic induction of alcohol dehydrogenase genein Arabidopsis. Plant Physiology 126, 742-749
Perazzolli M, Dominici P, Romero-Puertas M, Zago E, Zeier J, Sonoda M, Lamb C, Delledonne M (2004) Arabidopsis nonsymbiotic hemoglobin AHb1modulates nitric oxide bioactivity. The Plant Cell 16, 2785-2794
Pezeshki SR (1994) Responses of baldcypress (Taxodium distichum) seedlings tohypoxia: Leaf protein content, ribulose-1,5-bisphosphate carboxylase/oxygenase activityand photosynthesis. Photosynthetica 30, 59-68
Pezeshki SR (1996) Responses of threebottomlandspecies with different flood tolerance capabilities to various flooding regimes. Wetlands Ecology and Management 4, 245-256
Pezeshki SR (2001) Wetland plant responses to soil flooding. Environmental and Experimental Botany 46, 299-312
Pezeshki SR, Chambers JL (1985) Stomatal and photosynthetic response of sweet gum (Liquidambar styraciflua) to flooding. Canadian Journal of Forest Research 15, 371-375
Pezeshki SR, DeLaune RD (1998) Responses of seedlings of selected woody species to soil oxidation-reduction conditions. Environmental and Experimental Botany 40, 123-133
Pezeshki SR, Pardue JH, Delaune RD (1996) Leaf gas exchange and growth of flood-tolerant and flood-sensitive tree species under low soil redox conditions. Tree Physiology 16, 453-458
Postaire O, Verdoucq L, Maurel C (2007) Aquaporins in plants: From molecular structure to integrated functions. Advances in Botanical Research 46,75-136
Probert ME, Keating BA (2000) What soil constraints should be included in crop and forest models? Agriculture, Ecosystems and Environment 82, 273-281
Ram PC, Singh BB, Singh AK, Ram P, Singh PN, Singh HP, Boamfa I, Harren F, Santosa E, Jackson MB, Setter TL, Reuss J, Wade LJ, Pal Singh V,Singh RK (2002) Submergence tolerance in rainfed lowland rice: Physiological basis and prospects for cultivar improvement through marker-aided
breeding. Field Crops Research 76, 131-152
Roberts JK, Callis J, Jardetzky O, Walbot V, Freeling M (1984) Cytoplasmic acidosis as a determinant of flooding intolerance in plants. Proceedings of the National Academy of Sciences USA 81, 6029-6033
Sachs M, Freeling M, Okimoto R (1980) The anaerobic proteins of maize. Cell 20, 761-767
Sachs M, Vartapetian B (2007) Plant anaerobic stress I. Metabolic adaptation to oxygendeficiency. Plant Stress 1, 123-135
Schussler EE, Longstreth DJ (2000) Changes in cell structure during the formation of root aerenchyma in Sagittaria lancifolia (Alismataceae). American Journal of Botany 87, 12-19
Secchi F, Lovisolo C, Uehlein N, Kaldenhoff R, Schubert A (2007) Isolation and functional characterization of three aquaporins from olive (Olea europaea L.). Planta 225, 381-392
Sena Gomes AR, Kozlowski TT (1980) Growth responses and adaptations of Fraxinus pennsylvanica seedlings toflooding. Plant Physiology 66, 267-271
Setter TL, Ellis M, Laureles EV, Ella ES, Senadhira D, Mishra SB, Sarkarung S, Datta S (1997) Physiology andgenetics of submergence tolerance in rice. Annals of Botany 79, 67-77
Singh SN (2001) Exploring correlation between redox potential and other edaphic factors in field and laboratory conditions in relation to methane efflux. Environment International 27, 265-274
Soukup A, Armstrong W, Schreiber L, Franke R, Votrubova O (2007) Apoplastic barriers to radial oxygen loss and solute penetration: A chemical and functional comparison of the exodermis of two wetland species, Phragmites australis and Glyceria maxima New Phytologist 173. 264-278
Soukup A, Votrubova O, Cizkova H (2002) Development of anatomical structure of roots of Phragmites australis New Phytologist 153, 277-287
Steffens B, Wang J, Sauter M (2006) Interactions between ethylene, gibberellin and abscisic acid regulate emergence and growth rate of adventitious roots in deep water rice. Planta 223, 604-612
Subbaiah C, Sachs M (2003) Molecular and cellular adaptations of maize to flooding stress. Annals of Botany 91, 119-127
Summers J, Ratcliffe R, Jackson M (2000) Anoxia tolerance in the aquatic monocot Potamogeton pectinatus: Absence of oxygen stimulates elongation in association with anunusually large Pasteureffect. Journal of Experimental Botany 51, 1413-1422
Tadege M, Brandle R, Kuhlemeier C (1998) Anoxia tolerance in tobacco roots: Effect of overexpression of pyruvatedecarboxylase. Plant Journal 14, 327-335
Tang Z, Kozlowski T (1982) Some physiological and growth responses of Betula papyrifera seedlingsto flooding. Physiologia Plantarum 55, 415-420
Thomson CJ, Greenway H (1991) Metabolic evidence for stelar anoxia in maize roots exposed to low O2 concentrations. Plant Physiology 96, 1294-1301
Tournaire-Roux C, Sutka M, Javot H, Gout E, Gerbeau P, Luu D-T, Bligny R, Maurel C (2003) Cytosolic pH regulates root water transport during anoxic stress through gating of aquaporins. Nature 425, 393-397
Van Breusegem F, Dat JF (2006) Reactive oxygen species in plant cell death. Plant Physiology 141, 384-390
Vandeleur R, Niemietz C, Tilbrook J, Tyerman SD (2005) Roles of aquaporins in root responsesto irrigation. Plant and Soil 274, 141-161
Vartapetian BB (2006) Plant anaerobic stress as a novel trend in ecological physiology, biochemistry, and molecular biology: 2. Further development of the problem. Russian Journal of Plant Physiology 53, 711-738
Vartapetian BB, Andreeva IN, Generozova IP, Polyakova LI, Maslova IP, Dolgikh YI, Stepanova AY (2003) Functional electronmicroscopy in studies of plant response and adaptation to anaerobic stress. Annals of Botany 91,155-172
Vartapetian BB, Jackson M (1997) Plant adaptations to anaerobic stress. Annals of Botany 79, 3-20
Vartapetian BB, Polyakova LI (1998) Protective effect of exogenous nitrate on the mitochondrial ultrastructure of Oryza sativa coleoptiles under strictanoxia. Protoplasma 206, 163-167
Vasellati V, Oesterheld M, Medan D, Loreti J (2001) Effects of flooding and drought on the anatomy of Paspalum dilatatum Annals of Botany 88, 355-360
Visser E, Colmer T, Blom C, Voesenek L (2000)Changes in growth, porosity, and radial oxygen loss from adventitious roots of selectedmono- anddicotyledonous wetland species with contrasting types of aerenchyma. Plant, Cell and Environment 23, 1237-1245
Visser E, Nabben R, Blom C, Voesenek L (1997) Elongationby primary lateral roots and adventitious roots during conditions of hypoxia and high ethylene concentrations. Plant, Cell and Environment 20, 647-653
Visser E, Pierik R (2007). Inhibition of root elongation by ethylene in wetland and non-wetland plant species and the impact of longitudinal ventilation. Plant, Cell and Environment 30, 31-38
Voesenek L, Banga M, Thier R, Mudde C, Harren F, Barendse G, Blom C (1993) Submergence-induced ethylene synthesis, entrapment, and growth in two plant species with contrasting flooding resistances. Plant Physiology 103,783-791
Vuylsteker C, Dewaele E, Rambour S (1998) Auxin induced lateral root formation in chicory. Annals of Botany 81, 449-454
Yamamoto F, Sakata T, Terazawa K (1995) Physiological, morphological and anatomical response of Fraxinus mandshurica seedlings to flooding. Tree Physiology 15, 713-719
Yanar Y, Lipps PE, Deep IW (1997) Effect of soil saturation duration and soil water content on root rot of maize caused by Pythium arrhenomanes Plant. Disease 81, 475-480
Yordanova R, Christov K, Popova L (2004) Antioxidative enzymes in barley plants subjected to soil flooding. Environmental and Experimental Botany 51,93-101
Zarate-Valde JL, Zdsoski RJ, Lauchli AE (2006) Short-term effect of moisture on soil solution pH and soil Eh. on of the exodermis of two wetland species, Phragmites australis and Glyceria maxima New Phytologist 173. , 264-278
Soukup A, Votrubova O, Cizkova H (2002) Development of anatomical structure of roots of Phragmites australis New Phytologist 153, 277-287
Steffens B, Wang J, Sauter M (2006) Interactions between ethylene, gibberellin and abscisic acid regulateemergence and growth rate of adventitious roots in deepwaterrice. Planta 223, 604-612
Subbaiah C, Sachs M (2003) Molecular and cellular adaptations of maize to flooding stress. Annals of Botany 91, 119-127
Summers J, Ratcliffe R, Jackson M (2000) Anoxia tolerance in the aquatic monocot Potamogeton pectinatus: Absence of oxygen stimulates elongation in association with anunusually large Pasteur effect. Journal of Experimental Botany 51, 1413-1422
Tadege M, Brandle R, Kuhlemeier C (1998) Anoxia tolerance in tobacco roots: Effect of overexpression of pyruvatedecarboxylase. Plant Journal 14,327-335
Tang Z, Kozlowski T (1982) Some physiological and growth responses of Betula papyrifera seedlingsto flooding. Physiologia Plantarum 55, 415-420
Thomson CJ, Greenway H (1991) Metabolic evidence for stelar anoxia in maize roots exposed to low O2 concentrations. Plant Physiology 96, 1294-1301
Tournaire-Roux C, Sutka M, Javot H, Gout E, Gerbeau P, Luu D-T, Bligny R, Maurel C (2003) Cytosolic pH regulates root water transport during anoxic stress through gating of aquaporins. Nature 425, 393-397
Van Breusegem F, Dat JF (2006) Reactive oxygen species in plant cell death. Plant Physiology 141, 384-390
Vandeleur R, Niemietz C, Tilbrook J, Tyerman SD (2005) Roles of aquaporinsin root responsesto irrigation. Plant and Soil 274, 141-161
Vartapetian BB (2006) Plant anaerobic stress as a novel trend in ecological physiology, biochemistry, and molecular biology: 2. Further development of the problem. Russian Journal of Plant Physiology 53, 711-738
Vartapetian BB, Andreeva IN, Generozova IP, Polyakova LI, Maslova IP, Dolgikh YI, Stepanova AY (2003) Functional electronmicroscopy in studies of plant response and adaptation to anaerobic stress. Annals of Botany 91,155-172
Vartapetian BB, Jackson M (1997) Plant adaptations to anaerobic stress. Annals of Botany 79, 3-20
Vartapetian BB, Polyakova LI (1998) Protective effect of exogenous nitrate on the mitochondrial ultrastructure of Oryza sativa coleoptiles under strict anoxia. Protoplasma 206, 163-167
Vasellati V, Oesterheld M, Medan D, Loreti J (2001) Effects of flooding and drought on the anatomy of Paspalum dilatatum Annals of Botany 88, 355-360
Visser E, Colmer T, Blom C, Voesenek L (2000)Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono- and dicotyledonous wetland species with contrasting types of aerenchyma. Plant, Cell a nd Environment 23, 1237-1245
Visser E, Nabben R, Blom C, Voesenek L (1997) Elongationby primary lateral roots and adventitious roots during conditions of hypoxia and high ethylene concentrations. Plant, Cell and Environment 20, 647-653
Visser E, Pierik R (2007) Inhibition of root elongation by ethylene in wetland and non-wetland plant species and the impact of longitudinal ventilation. Plant Stress 2 (1), 20-27 ©2008 Global Science Books Plant, Cell and Environment 30, 31-38
Voesenek L, Banga M, Thier R, Mudde C, Harren F, Barendse G, Blom C (1993) Submergence-induced ethylene synthesis, entrapment, and growth in two plant species with contrasting flooding resistances. Plant Physiology 103,783-791
Vuylsteker C, Dewaele E, Rambour S (1998) Auxin induced lateral root formation in chicory. Annals of Botany 81, 449-454
Yamamoto F, Sakata T, Terazawa K (1995) Physiological, morphological and anatomical response of Fraxinus mandshurica seedlings to flooding. Tree Physiology 15, 713-719
Yanar Y, Lipps PE, Deep IW (1997) Effect of soil saturation duration and soil water content on root rot of maize caused by Pythium arrhenomanes Plant. Disease 81, 475-480
Yordanova R, Christov K, Popova L (2004) Antioxidative enzymes in barley plants subjected to soil flooding. Environmental and Experimental Botany 51,93-101
Zarate-Valde JL, Zdsoski RJ, Lauchli AE (2006) Short-term effect of moisture on soil solution pH and soil Eh.